Proteína de ferro-xofre
As proteínas de ferro-xofre son proteínas caracterizadas pola presenza de centros ou clusters de ferro-xofre que conteñen centros con dous, tres e catro ións ferro ligados a sulfuro en estados de oxidación variables. Os centros de ferro-xofre encóntranse en diversas metaloproteínas, como as ferredoxinas, así como na NADH deshidroxenase, hidroxenases, coencima Q – citocromo c redutase, sucinato – coencima Q redutase e nitroxenase.[1] Os centros de ferro-xofre son mellor coñecidos polo su papel nas reaccións de oxidación-redución de transporte de electróns en mitocondrias e cloroplastos. Os complexos I e II da fosforilación oxidativa teñen múltiples centros Fe–S. Teñen ademais outras moitas funcións como a catálise, como se ilustra coa aconitase, xeración de radicais como se exemplifica cos encimas dependentes da SAM, e a doazón de xofre na biosíntese de ácido lipoico e biotina. Ademais, algunhas proteínas de Fe–S regulan a expresión xénica. As proteínas Fe–S son vulnerables ao ataque por óxido nítrico bioxénico, formando complexos dinitrosil ferro. Na maioría das poteínas de Fe–S, os ligandos terminais sobre o Fe son tiolatos, mais hai excepcións.[2]
A frecuente presenza destas proteínas nas rutas metabólicas da maioría dos organismos levou a algúns científicos a teorizar que os compostos de ferro-xofre tiveron un papel significativo na orixe da vida na teoría do mundo de ferro-xofre.
Motivos estruturais
[editar | editar a fonte]En case todas as proteínas de Fe–S, os centros de Fe son tetraédricos e os ligandos terminais son centros de xofre de tipo tiolato de residuos cisteinil. Os centros sulfuro son de coordinación 2 ou 3. Os tres tipos máis comúns de centros ou clusters Fe–S son:
Centros 2Fe–2S
[editar | editar a fonte]
O sistema polimetálico máis simple é o centro ou cluster [Fe2S2], que está constituído por dous ións ferro unidos por dous ións sulfuro e coordinados por catro ligandos cisteína (nas ferredoxinas Fe2S2) ou por dúas cisteínas e dúas histidinas (nas proteínas de Rieske). As proteínas oxidadas conteñen dous ións Fe3+, mentres que as proteínas reducidas conteñen un ión Fe3+ e outro Fe2+. Estas especies poden estar en dous estados de oxidación: (FeIII)2 e FeIIIFeII. O dominio de ferro xofre CDGSH está tamén asociado cos centros 2Fe-2S.
Centros 4Fe–4S
[editar | editar a fonte]Un motivo común presenta catro ións ferro e catro ións sulfuro situados nos vértices dun centro con forma de cubo. Os centros de Fe están tipicamente coordinados ademais con ligandos cisteinil. As proteínas de transferencia de electróns [Fe4S4] (ferredoxinas [Fe4S4]) poden ser subdivididas en ferredoxinas de baixo potencial (o tipo bacteriano) e de alto potencial (HiPIP). As ferredoxinas de baixo e alto potencial están relacionadas polo seguinte esquema redox:

Nas HiPIP o centro oscila entre os estados [2Fe3+, 2Fe2+] (Fe4S42+) e [3Fe3+, Fe2+] (Fe4S43+). Os potenciais para esta parella redox van de 0,4 a 0,1 V. Nas ferredoxinas bacterianas, o par de estados de oxidación é [Fe3+, 3Fe2+] (Fe4S4+) e [2Fe3+, 2Fe2+] (Fe4S42+). Os potenciais para esta parella redox van de −0,3 a −0,7 V. As dúas familias de centros 4Fe–4S comparten o estado de oxidación Fe4S42+. A diferenza observada nas parellas de oxidación atribúese á cantidade de enlaces de hidróxeno, que afectan aos ligandos tiolato da cisteína. Outra parella redox que é aínda máis redutora que as ferredoxinas bacterianas atopámola na nitroxenase.
Algúns centros 4Fe–4S únense a substratos e son, por tanto, clasificados como cofactores encimáticos. Na aconitase, o centro Fe–S únese ao aconitato no centro de Fe que carece de ligando tiolato. O centro non sofre reacción redox, mais serve como un catalizador ácido de Lewis que converte o citrato en isocitrato. En encimas de radical SAM, o centro únese e reduce a S-adenosilmetionina para xerar un radical, que está implicado en moitas biosínteses.[3]
Centros 3Fe–4S
[editar | editar a fonte]As proteínas poden conter tamén centros [Fe3S4], que presentan un ferro menos que os máis comúns [Fe4S4]. Tres ións sulfuro enlazan cada un dous ións de ferro, mentres que o cuarto ión sulfuro enlaza tres ións de ferro. Os seus estados de oxidación formais poden variar de [Fe3S4]+ (forma todo-Fe3+) a [Fe3S4]2− (forma todo-Fe2+). En varias proteínas de ferro-xofre, o centro [Fe4S4] pode ser convertido reversiblemente por oxidación e perda dun ión ferro a un centro [Fe3S4]. Por exemplo, a forma inactiva da aconitase posúe un [Fe3S4] e actívase pola adición de Fe2+ e un redutor.
Outros centros Fe–S
[editar | editar a fonte]Existen outros sistemas polimetálicos máis complexos. Exemplos son os centros 8Fe e os 7Fe da nitroxenase. Na monóxido de carbono deshidroxenase e na [FeFe]-hidroxenase tamén existen centros Fe–S pouco comúns. En [NiFe] hidroxenases unidas a membrana tolerantes ao oxíxeno encóntrase un centro especial coordinado por 6 cisteínas de tipo [Fe4S3].[4][5]
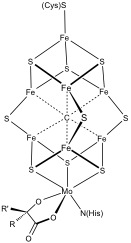
Biosíntese
[editar | editar a fonte]A biosíntese de centros de Fe–S foi ben estudada.[6][7][8] Onde se estudou máis extensamente a bioxénese dos centros de Fe-S foi nas bacterias Escherichia coli e Azotobacter vinelandii e no lévedo Saccharomyces cerevisiae. Ata agora identificáronse polo menos tres sistemas biosintéticos diferentes, chamados nif, suf, e isc, que se identificaron primeiramente en bacterias. O sistema nif é responsable dos centros presentes no encima nitroxenase. Os sistemas suf e isc son máis xerais.
O sistema isc de lévedos é o mellor descrito. Varias proteínas constitúen a maquinaria biosintética por medio da ruta isc. O proceso ocorre en tres grandes etapas: Primeiro o centro Fe-S ensámblase nun armazón proteíco e despois transfírese o centro ou cluster preformado ás proteínas receptoas. A primeira etapa deste proceso ocorre no citoplasma dos organismos procariotas ou nas mitocondrias dos eucariotas. Nos organismos superiores os centros Fe-S son despois transportados fóra da mitocondria para que se incorporen a encimas extramitocondriais. Estes organismos tamén posúen un conxunto de proteínas dedicadas ao transporte dos centros Fe-S e aos procesos de incorporación que non son homólogas ás proteínas atopadas en sistemas procariotas.
Análogos sintéticos
[editar | editar a fonte]Os análogos sintéticos dos centros Fe–S naturais foron descubertos primeiramente por Holm e colegas.[9] O tratamento de sales de ferro cunha mestura de tiolatos e sulfuro dá lugar a derivados como (Et4N)2Fe4S4(SCH2Ph)4].[10][11]
Notas
[editar | editar a fonte]- ↑ S. J. Lippard, J. M. Berg “Principles of Bioinorganic Chemistry” University Science Books: Mill Valley, CA; 1994. ISBN 0-935702-73-3.
- ↑ Bak, D. W.; Elliott, S. J. (2014). "Alternative FeS cluster ligands: tuning redox potentials and chemistry". Curr. Opin. Chem. Biol. 19: 50–58. PMID 24463764. doi:10.1016/j.cbpa.2013.12.015.
- ↑ Susan C. Wang; Perry A. Frey (2007). "S-adenosylmethionine as an oxidant: the radical SAM superfamily". Trends in Biochemical Sciences 32 (3): 101–10. PMID 17291766. doi:10.1016/j.tibs.2007.01.002.
- ↑ Fritsch, J; Scheerer, P; Frielingsdorf, S; Kroschinsky, S; Friedrich, B; Lenz, O; Spahn, CMT (2011-10-16). "The crystal structure of an oxygen-tolerant hydrogenase uncovers a novel iron-sulphur centre". Nature 479 (7372): 249–252. Bibcode:2011Natur.479..249F. PMID 22002606. doi:10.1038/nature10505.
- ↑ Shomura, Y; Yoon, KS; Nishihara, H; Higuchi, Y (2011-10-16). "Structural basis for a [4Fe-3S] cluster in the oxygen-tolerant membrane-bound [NiFe]-hydrogenase". Nature 479 (7372): 253–256. Bibcode:2011Natur.479..253S. PMID 22002607. doi:10.1038/nature10504.
- ↑ Johnson D, Dean DR, Smith AD, Johnson MK (2005). "Structure, function and formation of biological iron–sulfur clusters". Annual Review of Biochemistry 74 (1): 247–281. PMID 15952888. doi:10.1146/annurev.biochem.74.082803.133518.
- ↑ Johnson, M.K. and Smith, A.D. (2005) Iron–sulfur proteins in: Encyclopedia of Inorganic Chemistry (King, R.B., Ed.), 2nd edn, John Wiley & Sons, Chichester.
- ↑ Lill R, Mühlenhoff U (2005). "Iron–sulfur-protein biogenesis in eukaryotes". Trends in Biochemical Sciences 30 (3): 133–141. PMID 15752985. doi:10.1016/j.tibs.2005.01.006.
- ↑ T. Herskovitz; B. A. Averill; R. H. Holm; J. A. Ibers; W. D. Phillips; J. F. Weiher (1972). "Structure and Properties of a Synthetic Analogue of Bacterial Iron-Sulfur Proteins". Proceedings of the National Academy of Sciences 69 (9): 2437–2441. Bibcode:1972PNAS...69.2437H. PMC 426959. PMID 4506765. doi:10.1073/pnas.69.9.2437.
- ↑ Holm, R. H.; Lo, W. (2016). "Structural Conversions of Synthetic and Protein-Bound Iron-Sulfur Clusters". Chem. Rev. 116 (22): 13685–13713. PMID 27933770. doi:10.1021/acs.chemrev.6b00276.
- ↑ Lee, S. C.; Lo, W.; Holm, R. H. (2014). "Developments in the Biomimetic Chemistry of Cubane-Type and Higher Nuclearity Iron–Sulfur Clusters". Chemical Reviews 114 (7): 3579–3600. PMC 3982595. PMID 24410527. doi:10.1021/cr4004067.
Véxase tamén
[editar | editar a fonte]Outros artigos
[editar | editar a fonte]Bibliografía
[editar | editar a fonte]- Beinert, H. (2000). "Iron-sulfur proteins: ancient structures, still full of surprises". J. Biol. Inorg. Chem. 5 (1): 2–15. PMID 10766431. doi:10.1007/s007750050002.
- Beinert, H.; Kiley, P.J. (1999). "Fe-S proteins in sensing and regulatory functions". Curr. Opin. Chem. Biol. 3 (2): 152–157. PMID 10226040. doi:10.1016/S1367-5931(99)80027-1.
- Johnson, M.K. (1998). "Iron-sulfur proteins: new roles for old clusters". Curr. Opin. Chem. Biol. 2 (2): 173–181. PMID 9667933. doi:10.1016/S1367-5931(98)80058-6.
- Nomenclature Committee of the International Union of Biochemistry (NC-IUB) (1979). "Nomenclature of iron-sulfur proteins. Recommendations 1978". Eur. J. Biochem. 93 (3): 427–430. PMID 421685. doi:10.1111/j.1432-1033.1979.tb12839.x.
- Noodleman, L., Lovell, T., Liu, T., Himo, F. and Torres, R.A. (2002). "Insights into properties and energetics of iron-sulfur proteins from simple clusters to nitrogenase". Curr. Opin. Chem. Biol. 6 (2): 259–273. PMID 12039013. doi:10.1016/S1367-5931(02)00309-5.
- Spiro, T.G., Ed. (1982). Iron-sulfur proteins. New York: Wiley. ISBN 0-471-07738-0.
Ligazóns externas
[editar | editar a fonte]- Iron-Sulfur Proteins Medical Subject Headings (MeSH) na Biblioteca Nacional de Medicina dos EUA.
- Exemplos de centros ferro-xofre
